آمازون مجوز استفاده اضطراری از کیت تست خانگی کرونا را از FDA گرفت






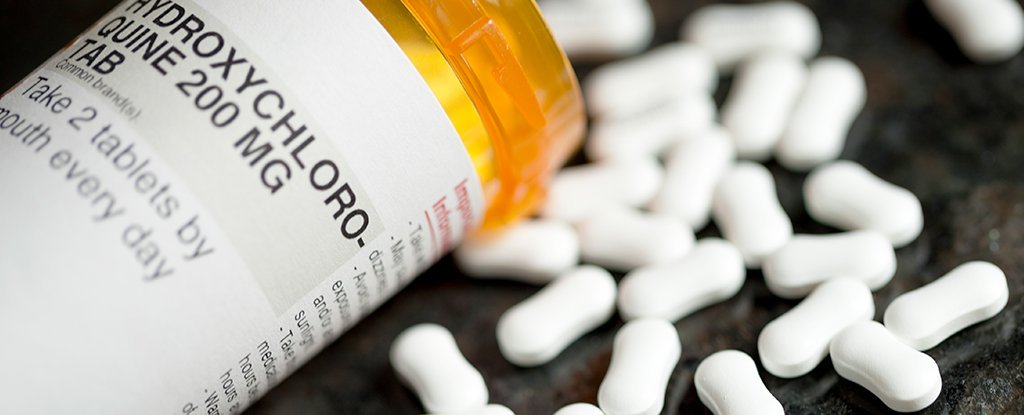
روز دوشنبه بعد از اینکه سازمان غذا و دارو (FDA) اعلام کرد که داروهای ضدمالاریا برای درمان بیماری ویروس کرونا مفید نیستند، حالا ۶۰ میلیون قرص از این داروها روی دست آمریکا باقی مانده است.
FDA در تاریخ 28 مارس امسال استفاده از داروهای کلرین (chloroquine) و هیدروکسی کلرین (hydroxychloroquine) را برای درمان بیماران کووید۱۹ تایید کرده بود، اما بهدنبال بحثهای زیاد درباره اثرگذاری و خطرات این داروها، روز دوشنبه این هفته استفاده از آنها را منع کرد.
این سازمان گفته است که این داروها احتمالا برای درمان بیماری ویروس کرونا بیتاثیر هستند و میتوانند منجر به ایجاد عوارض جدی قلبی در بیماران بشوند.

سخنگوی وزارت بهداشت آمریکا روز دوشنبه به نیویورکتایمز گفت که دولت آمریکا حدود ۳۱ میلیون قرص هیدروکسی کلرین در مراکز درمانی ایالتها توزیع کرده و ۶۳ میلیون قرص هنوز در انبارها باقی مانده است. او همچنین گفت که مقامات آمریکا در حال گفتگو با اهداکنندگان دارو هستند تا گزینههای دیگری برای استفاده از قرصهای باقیمانده پیدا کنند.
دکتر ریک برایت (Rick Bright) رییس سابق موسسه دولتی توسعه و تحقیقات پیشرفته زیستپزشکی (BARDA) روز دوشنبه در توییتر گفت که داروهای مذکور هرگز نباید وارد کشور آمریکا میشدند.
داروی هیدروکسی کلرین همچنان مورد تایید FDA برای درمان مالاریا است، اما بعید است که جمعیت آمریکا در حالحاضر نیاز به ۶۶ میلیون قرص از آن داشته باشد.
دونالد ترامپ هنوز صحبتی درباره تصمیم FDA برای ممنوع کردن استفاده از هیدروکسی کلرین برای درمان کووید۱۹ نکرده است؛ اما پیتر ناوارو (Peter Navarro) مشاور تجاری ترامپ روز دوشنبه به نیویورکتایمر گفت که چرخش ۱۸۰ درجهای FDA، یک اشتباه بزرگ توسط بوروکراتهایی بود که از کار کردن با دولت تنفر دارند.
در ماه مه امسال، فرانسه استفاده از هیدروکسی کلرین را برای درمان کووید۱۹ ممنوع کرد، در حالیکه انگلیس حدود ۱۶ میلیون قرص از این دارو را سفارش داده بود.
نوشته آمریکا دیگر نمیتواند 60 میلیون قرص ضدمالاریا را برای درمان ویروس کرونا استفاده کند! اولین بار در اخبار تکنولوژی و فناوری پدیدار شد.

در طول یک دهه گذشته، تجویز داروهای ژنریک یا عمومی حدود ۱.۷ تریلیون دلار برای آمریکا درآمد داشته است. سازمان غذا و دارو آمریکا (FDA) در سال 2018 رکورد ۷۸۱ داروی ژنریک جدید را به ثبت رساند که شامل نسخههای ژنریک داروهای Cialis ،Levitra و Lyrica میشوند.
سال گذشته هم نسخههای ژنریک داروهایی مانند Lipitor ،Nexium ،Prozac و Xanax روانه بازار شده بود. بزرگسالان معمولا بزرگترین خریداران این نوع داروها هستند، چراکه هم بیشترین درمانها را دریافت میکنند و هم درآمد ثابتی دارند. با اینحال، همه ما در زندگی خود دستکم از یک قرص مسکن یا آنتیبیوتیک ژنریک استفاده کردهایم.
اما سوال اساسی اینجاست که آیا داروهای ژنریک مطمئن و بیخطر هستند؟ باید بگوییم که اگر سازندگان دارو از قوانین سختگیرانه FDA تبعیت کنند پاسخ سوال مثبت است؛ اما FDA برای داروهایی ژنریکی که در خارج از کشور آمریکا تولید میشوند، براساس اعتبار شرکتها عمل میکند.

حدود هشتاد درصد از مواد تشکیلدهنده فعال داروها و چهل درصد از داروهای ژنریکی که در آمریکا مورد استفاده قرار میگیرند، در خارج از این کشور ساخته میشوند.
همه ما میدانیم که بیخطر بودن درمانهای نسخهای بسیار حیاتی است و حالا مطالعه جدیدی که در مجله Annals of Pharmacotherapy چاپ شده، به نگرانیهایی در اینباره اشاره کرده است.
سازندگان داروهای ژنریک معمولا یا پودر داروها را با استفاده از مواد تشکیلدهنده فعال میسازند و یا این مواد را از سایر شرکتها خریداری کرده و سپس آنها را تبدیل به قرص، پماد یا محصولات تزریقی میکنند.
آمار نشان میدهند که در سال 2010، تقریبا ۶۴ درصد از شرکتهای سازنده خارجی، بهویژه در کشورهای هند و چین، هرگز توسط FDA مورد بازرسی قرار نگرفتهاند و در سال 2015 تقریبا ۳۳ درصد از آنها بدون بازرسیهای مذکور به کار خود ادامه میدادهاند.
ضمنا در مواردی هم که شرکتهای مستقر در خارج از آمریکا مورد بازرسی قرار گرفتهاند، قبل از انجام بازرسیها به آنها اطلاع داده شده است که این کار در واقع به معنای دادن فرصت کافی به آنها برای مخفی کردن تخلفهایشان بوده است. این در حالی است که شرکتهای داخل آمریکا بدون اعلام قبلی بازرسی شدهاند.

در فاصله بین سالهای 2010 تا 2015 که بازرسیهای FDA از شرکتهای خارجی انجام میشد، بسیاری از محصولات این سازندگان بهخاطر فعالیتهای غیرشفاف یا نقض جدی استانداردهای کیفیت، از بارگیری به داخل آمریکا منع شدند.
در مواردی هم تولیدکنندگان متخلف سعی کرده بودند مدارک جعلی داروهایشان را قبل از شروع بازدیدها پاره کرده یا آنها را به بیرون از شرکت انتقال دهند، و حتی اطلاعات مربوط به کیفیت داروها را دستکاری کنند.
در سال 2013 نیز علیه شرکت داروسازی Ranbaxy Corporation، بهخاطر بارگیری داروهای غیراستاندارد به داخل آمریکا و همچنین ارایه اطلاعات نادرست به FDA، اقامه دعوا گردید که در نتیجه آن، شرکت علاوهبر جمعآوری ۷۳ میلیون قرص دارو از بازار، محکوم به پرداخت ۵۰۰ میلیون دلار هم شد.
اینگونه مشکلات در رابطه با کیفیت داروها میتوانند بسیار کشنده باشند. برای مثال، در سال 2008 تعداد صد بیمار آمریکایی بعد از مصرف داروهای ژنریک هپارین که محصول سازندگان خارجی بودند، فوت کردند. هپارین یک داروی ضدانعقاد خون است که سالانه حدود ۱۰ میلیون بیمار از آن استفاده میکنند و از رودههای خوک بدست میآید.

در این داروهای تقلبی، برخی از هپارینها با کندروایتین (chondroitin) که یک مکمل غذایی برای دردهای مشترک است، جایگزین شده بودند. یکی از سازندگان هپارین که توسط FDA بازرسی شده بود، بعد از آنکه مشخص شد علاوهبر مواد خام تاییدنشده، از تجهیزات ذخیره غیراستاندارد و تستهای ناکافی برای تشخیص ناخالصیها نیز استفاده کرده، یک برگه هشدار دریافت کرد.
این مشکلات تا حالا نیز ادامه داشتهاند. برای نمونه، در سالهای 2018 و 2019 هزاران داروی ضدزخممعده و فشار خون بهخاطر آلودگی با ترکیبات سرطانزا از بازار جمعآوری شدند.
با مشاهده موارد فوق، حالا این سوال پیش میآید که در هنگام بازرسیها چه میزان تخلف کشف شده و چه تعداد از آنها بهطور رسمی اعلام نشده است.
اگر بخواهیم بهطور نسبی بگوییم، تعداد داروهایی که ثابت شده فاسد یا غیراستاندارد بودهاند، کم بوده است؛ ضمن اینکه خود FDA هم از سال 2010 به اینطرف، پیشرفتهای زیادی را در این زمینه داشته است. با اینحال، باید بگوییم که احتمال خطر همچنان وجود دارد.
سوال اساسی درباره داروهای ژنریک این است که بیمارانی که از این داروها استفاده میکنند، تا چهاندازه باید به آنها اعتماد داشته باشند؟ شواهد نشان میدهد که FDA نمیتواند به اسناد و مدارکی که سازندگان خارجی برای تضمین استانداردهای کیفیت محصولاتشان ارایه میکنند، اطمینان کند.
تمایل شرکتهای خارجی به ارایه اطلاعات غلط و دستکاری مدارک، برای فروختن داروهای کمکیفیت و ناسالم خود به شهروندان، چیزی است که تنها با بازرسیهای مکرر اعلامنشده و یا تست کردن بستههایی که وارد کشور میشوند، قابل پیشگیری است.
بیمارانی که داروهای تجویزی دریافت میکنند، بسیار آسیبپذیر هستند و به هیچوجه نباید داروهای بیکیفیت مصرف کنند. گرچه انجام بازرسیهای اعلامنشده از شرکتهای خارجی، برای FDA هزینهبر و چالشبرانگیز است؛ اما این سازمان باید در راستای اهداف تعیینشده خود که همانا حفظ سلامت بیماران است، عمل کند و هیچ اغماضی در اینباره نداشته باشد.
نوشته درباره داروهای ژنریک چه میدانیم؟ آیا آنها قابل اطمینان هستند؟ اولین بار در اخبار تکنولوژی و فناوری پدیدار شد.